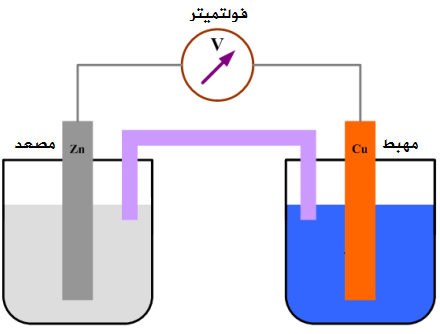
الخلايا الفولتية ( كهروكيميائية ) Voltaic Cell : تستخدم تفاعل أكسدة واختزال التلقائي لتوليد تيار كهربائي .
كما هو مشار في الصورة 1 , لنبدأ بقطب الزنك . من خلال المعادلة الموجودة , قد تحول الزنك إلى أيونات الزنك فاقدًا إلكترونين . وفقدان الإلكترونات يعرف بالأكسدة Oxidation , أي أن تفاعل الأكسدة حدث في قطب الزنك Zn وهذا يعني أن قطب الزنك Zn هو الأنود لأن الأكسدة تحدث عند الأنود Anode . إن قطب الزنك Zn هو مصدر الإلكترونات أي أنه قطب سالب الشحنة وتتدفق هذه الإلكترونات عبر السلك لتنتج تيارًا كهربائيًا Electric Current .
 |
| صورة 1 |
وعندما يصلان هذان الإلكترونان إلى قطب النحاس Cu , تلتقط أيونات النحاس Cu هذين الإلكترونين لتتحول إلى نحاس الصلب . إن اكتساب الإلكترونات يعرف بالاختزال Reduction . وتفاعل الاختزال قد وقع عند قطب النحاس Cu وهذا يعني أن قطب النحاس هو الكاثود Cathode أي أنه قطب موجب الشحنة . هذا التفاعل تلقائي Spontaneous Reaction , حيث إن الجهد القياسي للخلية E يساوي 1.10+ فولت والقيمة الموجبة لجهد الخلية تعني أن التفاعل تلقائي وينتج عنه تيار كهربائي .
أما الخلية الإلكتروليتية Electrolytic Cell فتستخدم التيار الكهربائي لإحداث تفاعل أكسدة واختزال غير تلقائي . ويسمى استخدام الطاقة الكهربائية للحصول على تفاعل كيميائي التحليل الكهربائي Electrolysis .
لاحظوا معادلة التفاعل الكلي للخلية الإلكتروليتية . بدأ التفاعل بنحاس الصلب وأيونات الزنك ونتج عنه أيونات النحاس والزنك الصلب وهو تفاعل عكسي للتفاعل السابق في الخلية الفولتية . إذ أن المتفاعلات في هذا التفاعل كانت تمثل النواتج لتفاعل الخلية الفولتية . ولإيجاد الجهد القياسي للخلية , نعكس إشارة قيمة جهد الخلية الفولتية من موجب إلى سالب لأن التفاعل كما ذكرنا قبل قليل عكسي ليصبح الجهد القياسي E في هذه الخلية الإلكتروليتية 1.10- فولت . والقيمة السالبة لجهد خلية تعني أن تفاعل الأكسدة والاختزال غير تلقائي Non spontaneous reactions , أي أنه لم يحدث من تلقاء نفسه . إذا يحتاج حدوث هذا التفاعل إلى مصدر طاقة خارجي كالبطارية ولهذه الغاية ضعوا مثلًا بطارية ضمن الدائرة الكهربائية في الصورة 1 على أن يكون الطرف السالب من البطارية على اليسار بينما يقع الطرف الموجب على اليمين . وهذان الطرفان هما مصدر الجهد الكهربائي لتتحول إلى صورة 2 . ويحتاج نشوء التفاعل واحد 1.10 فولت على الأقل .
لاحظوا أن الإلكترونات تتدفق من الطرف السالب للبطارية وتجبر الإلكترونات على الاتجاه إلى قطب الزنك Zn , فلو نظرتم إلى هذين الإلكترونين في الصورة 2 , لوجدتم أن هناك فرصة لاختزال أيونات الزنك أي أن أيونات الزنك تكتسب الإلكترونات وتتحول إلى الزنك الصلب الذي تشكل على قطب الزنك Zn . وهذا يشير إلى أن تفاعل الاختزال قد حدث هذه المرة عند قطب الزنك لهذا يصبح الكاثود في هذه الخلية . وتم إجبار الالكترونات على الاتجاه إلى قطب الزنك مما يجعله قطب سالب الشحنة في هذه الخلية . وتقوم البطارية أيضًا بسحب الإلكترونات من قطب النحاس Cu أي أن قطب النحاس Cu يفقد الإلكترونات التي تتجه نحو الطرف الموجب من البطارية وهذا ما يجعل قطب النحاس Cu موجب الشحنة وهو أيضًا التفاعل الذي يحدث عنده الأكسدة إذ أن النحاس الصلب يفقد الإلتكرونات ويتحول إلى أيونات النحاس وهذا يعني أن تفاعل الأكسدة قد حدث هذه المرة عند قطب النحاس Cu . أي أنه هو الأنود في هذه الخلية لأن تفاعل الأكسدة يحدث عند الأنود .
إذًا الخلايا الفولتية قد أنشأت تيارًا لأن تفاعل الأكسدة والاختزال كان تلقائيًا . أما في الخلايا الإلكتروليتية فكان لابد من استخدام تيار كهربائي أو مصدر طاقة خارجي حتى يحدث تفاعل الأكسدة والاختزال غير تلقائي . ومن الجدير بالذكر , أن إشارة أقطاب الخلايا الإلكتروليتية والفولتية متعاكسة . فلو نظرتم مثلًا في الخلايا الفولتية لوجدتم أن الأنود هو الزنك Zn وهو قطب سالب الشحنة هنا حيث يمثل مصدر الإلكترونات , بينما القطب السالب الشحنة في الخلية الإلكتروليتية هو الكاثود لأنه قد تم إجبار الإلكتورنت بواسطة البطارية على الاتجاه نحو قطب الزنك . لاحظوا أيضًا أن قطب السالب للخلية الإلكتروليتية يتطابق مع الطرف السالب من البطارية وكذلك الحال بالنسبة للقطب الموجب للخلية , إذ أنه يتطابق مع الطرف الموجب من البطارية . بالتالي إن أردتم معرفة القطب السالب والموجب في الخلية الإلكتروليتية فما عليكم سوى النظر طرفي البطارية .
أما الجزء الموجود في الصورتين ولم أذكره , فهي القنطرة الملحية Salt Bridge تحتوي على ملح إلكتروليتي مثل KCl . وهي تؤدي دورًا مهمًا في استمرارية تفاعل الأكسدة والاختزال .
كل الشكر لمنصة مدرسة
ليست هناك تعليقات:
إرسال تعليق